编者按

肥胖所带来的公共健康问题日益严重。美国2017-2018与2018-2020年3月肥胖率抽样调查结果显示,美国20岁以上人群肥胖率高达42.4%,严重肥胖率为9.2%,20岁以下儿童肥胖率近20%[1]。我国儿童及成人超重/肥胖状况同样不容乐观。基于中国居民营养与慢性病状况的调查结果显示,2015-2019年,成人超重与肥胖率分别高达34.3%和16.4%,2019年儿童超重与肥胖率分别为13.9%和9.6%[2]。肥胖是大多数代谢危险因素和CKD的根源,目前未得到足够的重视。
近年来,代谢综合征(MetS)患者死亡率明显增高。糖尿病合并心肾高危因素,增加不良事件风险。随着UACR增加,糖尿病患者的心血管事件风险增加2.5倍,肾脏事件风险增加3倍,心血管危险因素共存使心血管事件风险增加3-6倍[3,4]。糖尿病相关慢性肾病(DKD)患者往往多种CVD共存,随疾病进展CVD患病率持续升高[5,6](图1)。糖尿病肾病+CKD全因及心血管死亡率明显增加[7](图2)。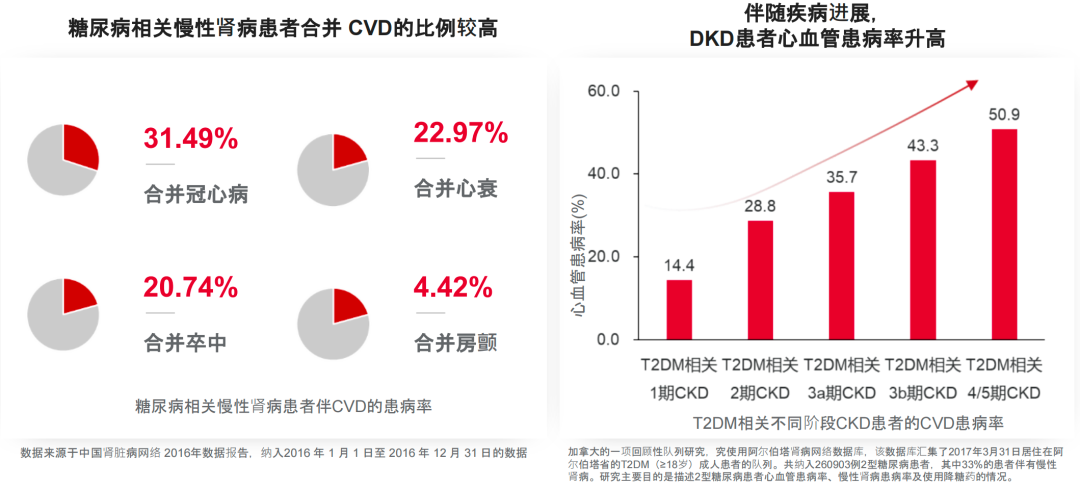
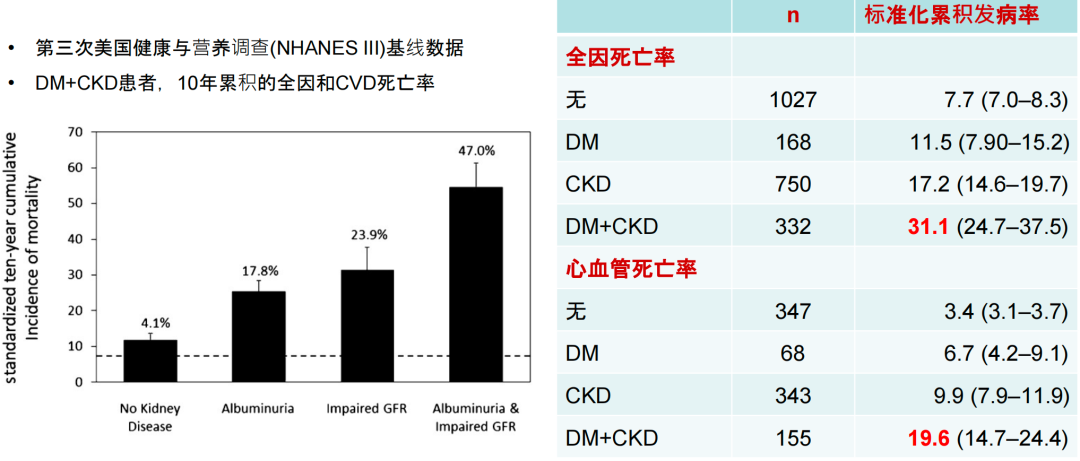
图2. 糖尿病肾病+CKD全因及心血管死亡率明显增加
过量和功能紊乱的脂肪组织可以引发炎症、胰岛素抵抗和代谢问题,导致全身性的影响,增加CVD的风险。代谢异常在心血管与肾脏之间的相互关系中起到了关键的病理生理作用,而CKD则是这一过程中连接代谢危险因素和心血管疾病的桥梁。随着新型药物的研发,如SGLT2抑制剂、GLP-1受体激动剂和RAAS抑制剂,我们有可能同时改善代谢、肾脏和心血管的健康。同时,我们也必须考虑到社会经济地位等健康的社会决定因素(SDOH)对代谢、肾脏和心血管之间相互关联的影响。我们不能仅仅将心肾综合征和代谢性疾病视为独立的状况,而应该将它们视为一个综合的、相互关联的体系来整体考虑。在此背景下,美国心脏协会(AHA)提出了CKM的新概念,旨在提高全球对心血管、肾脏和代谢健康的关注[8]。
过多的脂肪组织,尤其是内脏脂肪组织过多和失调,所导致的促炎因子分泌过多和其氧化产物对动脉、心血管和肾脏的损伤是CKM发生发展的最主要机制;代谢相关炎症致外周组织发生胰岛素抵抗、糖耐量异常,促炎因子、氧化应激产物对心血管和肾脏同时造成损伤(图3)[8]。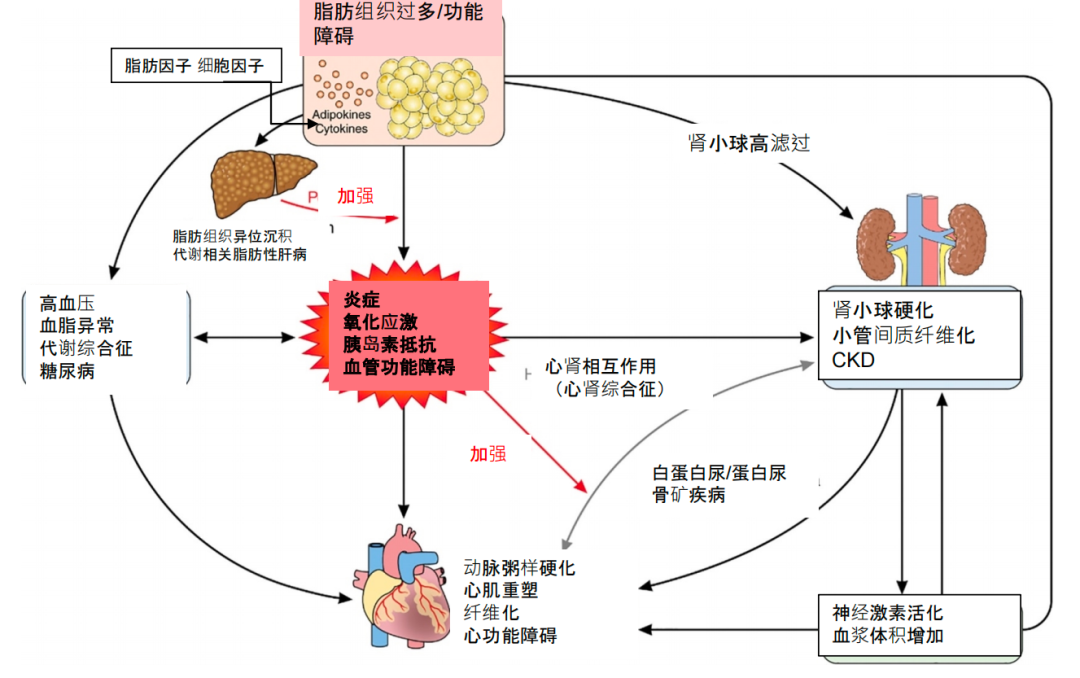
图3. CKM综合征的主要发生机制
CKM分期方法 CKM依据病理生理机制、疾病风险和防治的可能性分为5期(图4)
CKM依据病理生理机制、疾病风险和防治的可能性分为5期(图4)0期:无CKM危险因素,即BMI、腰围、血糖、血压、血脂均正常,且无CKD或亚临床/临床CVD。
1期:过度或异常的脂肪积累,即超重/肥胖、腹型肥胖或脂肪组织功能异常,但未合并其他代谢危险因素或CKD。
2期:存在代谢危险因素和CKD,即合并代谢危险因素(高甘油三酯血症-≥135mg/dL、高血压、糖尿病、代谢综合征)或中等至高危CKD。
3期:患CKM且合并亚临床CVD,或处于同等危险程度(经评估为高危CVD或极高危CKD,例如CKD4或5期或极高危CKD)。
4期:患CKM且合并CVD,4a期无肾衰竭;4b期合并肾衰竭。
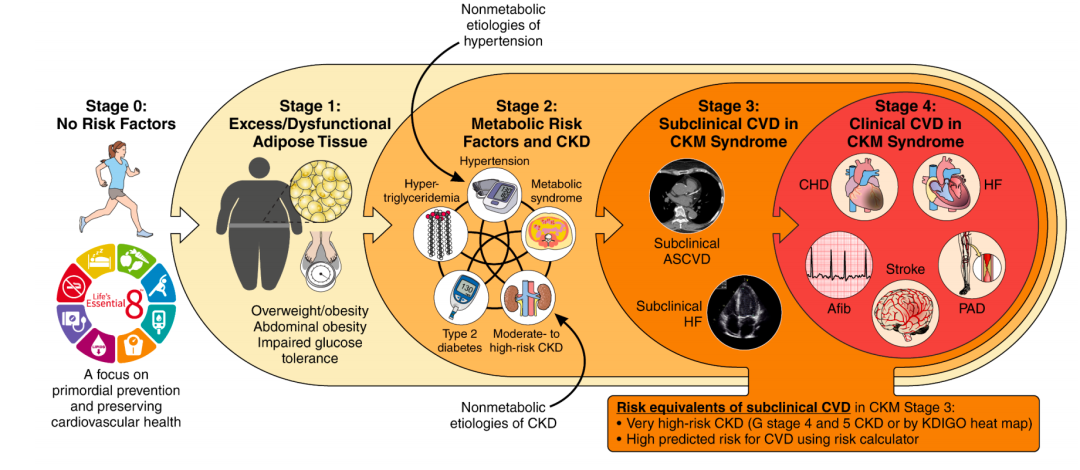
CKM分期原则强调亚临床状况早期发现的重要性,主要关注心血管疾病,需要额外关注肾衰竭。
可提高CKM综合征风险的因素包括慢性炎症状态(如类风湿、狼疮等)、 高危人群(如南亚血统、经济地位较低)、 较高负担的不良健康社会决定因素、 心理健康障碍 (抑郁或焦虑)、 睡眠障碍 (如呼吸睡眠暂停)、过早绝经史(年龄
